El silicio
El silicio es el segundo elemento del planeta más abundante, el primero es el oxígeno. Pertenece a la familia de los carbonoideos en la tabla periódica. Tiene 14 electrones y 14 protones, pero en términos de interés, solo nos interesan los 4 electrones que dispone en su zona de valencia. Se presenta en la naturaleza de dos formas distintas, una amorfa y otra cristalizada. En su forma amorfa tiene un color marrón, en su variante cristalizada tiene forma de octaedros de color azul grisáceo. Es más activo en su forma amorfa que en su forma cristalizada.
Se utiliza para cerámicas, vidrios, esmaltados, semiconductor electrónico, ladrillos, y en general, para muchos tipos de aleación en la industria de la fundición. Otros usos derivados del silicio es para fabricar siliconas, materiales abrasivos, láser y material fertilizante. Como se puede observar, el silicio y sus derivados se utilizan para casi todo. Entendemos como derivado, el carburo de silicio, dióxido de silicio, etc.
El silicio se presenta en la naturaleza como arena, amatista, pedernal, jaspe, ágata, cuarzo, etc, esto en lo referente al óxido de silicio.
Como un silicato lo encontraremos en el granito, arcilla, feldespato, entre otros.
Es resistente a los ácidos, pero reacciona bien con otros elementos, los alcalinos.
Para poderlo utilizar, hay que calentarlo en un horno eléctrico con temperaturas superiores a los 3000°C.
Aunque su pureza por este método es del 99%, cuando se necesita utilizar en componentes electrónicos y placas fotovoltaicas,
se tiene que realizar otro proceso adicional, nos referimos a un tratamiento químico.
Semiconductores
Para poder elegir un elemento como semiconductor, se tienen que tener en cuenta ciertos factores:
1. La cristalinidad del silicio
Es un factor esencial, dependiendo de la cristalinidad se podrá ejecutar un método u otro para extraer y utilizar el elemento. La cristalinidad se refiere a la disposición que tienen los átomos en la estructura cristalina. El silicio se puede encontrar en tres estados cristalinos: monocristalino, policristalino y amorfo.
2. Absorción del silicio
Nos referimos al coeficiente de absorción que tienen los elementos sobre la luz, o mejor dicho, sobre unas longitudes de onda. Si un material dispone de un coeficiente pequeño significará que tiene poca absorción. Por esto, las células de silicio cristalino tienen un espesor considerable, porque su coeficiente no es elevado.
3. El coste de extracción del silicio
Por supuesto, tenemos que tener en cuenta este factor. Siempre estará estrechamente relacionado con la extracción del material, su manipulación, los métodos para purificarlo, etc.
Estructura del silicio
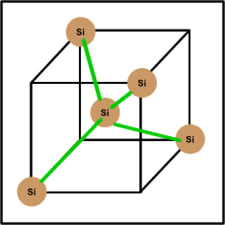
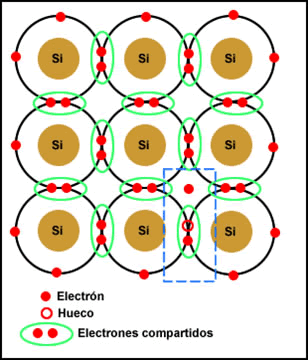
Como podemos observar en el dibujo, el átomo de silicio presenta un enlace covalente, esto quiere decir que cada átomo está
unido a otros cuatro átomos y compartiendo sus electrones de valencia. Es así, porque de otra manera el silicio no tendría el
equilibrio en la capa de valencia, necesita 8 electrones para su estabilidad. El enlace covalente lo forman todos los elementos del grupo IV de la
tabla periódica, al cual pertenece el silicio.
Al aplicarle energía externa, ya sea de calor o de luz, se rompen los enlaces quedando un electrón libre por cada enlace roto, pero
a su vez, se tiene un hueco vacío, el que ocupaba el electrón. De esta forma se obtiene corriente eléctrica, por el movimiento
de los electrones hacía los potenciales positivos y del movimiento de los huecos hacía los potenciales negativos.
Esto sucede así siempre que se utiliza al silicio como un semiconductor intrínseco.
Cuando queremos usar el silicio como semiconductor extrínseco, se colocan impurezas en el enlace covalente, lo cual hace que sea
más fácil ganar o perder un electrón.
Pero esto, lo veremos en la página destinada a la unión N-P.